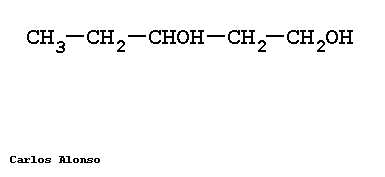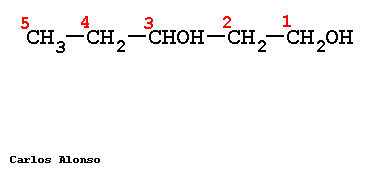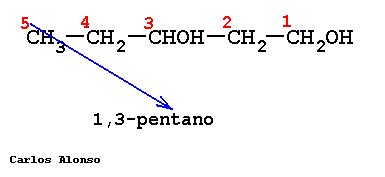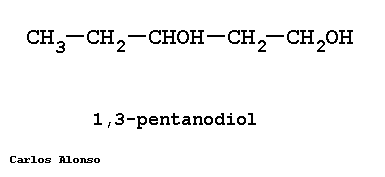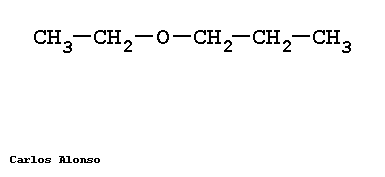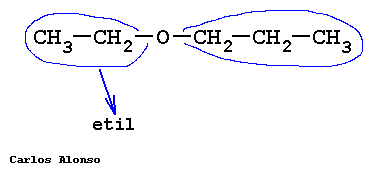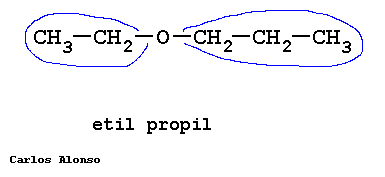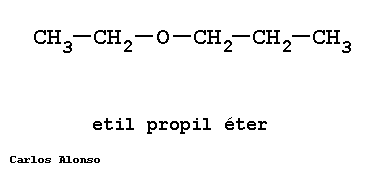Monosacáridos
Los glúcidos más simples, los monosacáridos, están formados por una sola molécula; no pueden ser hidrolizados a glúcidos más pequeños. La fórmula química general de un monosacárido no modificado es (CH2O)n, donde n es cualquier número igual o mayor a tres, su límite es de 7 carbonos. Los monosacáridos poseen siempre un grupo carbonilo en uno de sus átomos de carbono y grupos hidroxilo en el resto, por lo que pueden considerarse polialcoholes.
Polisacáridos
Los polisacáridos son cadenas, ramificadas o no, de más de diez monosacáridos, resultan de la condensación de muchas moléculas de monosacáridos con la pérdida de varias moléculas de agua. Su fórmula empírica es: (C6 H10 O5)n. Los polisacáridos representan una clase importante de polímeros biológicos y su función en los organismos vivos está relacionada usualmente con estructura o almacenamiento. El almidón es usado como una forma de almacenar monosacáridos en las plantas, siendo encontrado en la forma deamilosa y la amilopectina (ramificada). En animales, se usa el glucógeno en vez de almidón el cual es estructuralmente similar pero más densamente ramificado. Las propiedades del glucógeno le permiten ser metabolizado más rápidamente, lo cual se ajusta a la vida activa de los animales con locomoción.
para informarce mas acerca de los demas tipos aca les dejo el link: http://es.wikipedia.org/wiki/Hidratos_de_carbono
 El término "hidrato de carbono" o "carbohidrato" es poco apropiado, ya que estas moléculas no son átomos de carbono hidratados, es decir, enlazados a moléculas de agua, sino que constan de átomos de carbono unidos a otros grupos funcionales. Este nombre proviene de la nomenclatura química del siglo XIX, ya que las primeras sustancias aisladas respondían a la fórmula elemental Cn(H2O)n (donde "n" es un entero=De 3 en adelante; según el número de átomos). De aquí que el término "carbono-hidratado" se haya mantenido, si bien posteriormente se vio que otras moléculas con las mismas características químicas no se corresponden con esta fórmula. Además, los textos científicos anglosajones aún insisten en denominarloscarbohydrates lo que induce a pensar que este es su nombre correcto. Del mismo modo, en dietética, se usa con más frecuencia la denominación de carbohidratos.
El término "hidrato de carbono" o "carbohidrato" es poco apropiado, ya que estas moléculas no son átomos de carbono hidratados, es decir, enlazados a moléculas de agua, sino que constan de átomos de carbono unidos a otros grupos funcionales. Este nombre proviene de la nomenclatura química del siglo XIX, ya que las primeras sustancias aisladas respondían a la fórmula elemental Cn(H2O)n (donde "n" es un entero=De 3 en adelante; según el número de átomos). De aquí que el término "carbono-hidratado" se haya mantenido, si bien posteriormente se vio que otras moléculas con las mismas características químicas no se corresponden con esta fórmula. Además, los textos científicos anglosajones aún insisten en denominarloscarbohydrates lo que induce a pensar que este es su nombre correcto. Del mismo modo, en dietética, se usa con más frecuencia la denominación de carbohidratos.Los glúcidos pueden sufrir reacciones de esterificación, aminación, reducción, oxidación, lo cual otorga a cada una de las estructuras una propiedad especifica, como puede ser de solubilidad.
POLÍMEROS:
Los polímeros son macromoléculas (generalmente orgánicas) formadas por la unión de moléculas más pequeñas llamadas monómeros.

Los Detergentes
Jabones Artesanales
Son sustitutivos del jabón y su coste es mucho menor que el de los jabones. No están hechos a partir de grasas animales ni vegetales sino de derivados del petróleo.Son sustitutivos del jabón y su coste es mucho menor que el de los jabones. No están hechos a partir de grasas animales ni vegetales sino de derivados del petróleo.
Un detergente comercial está hecho de varios componentes cada uno con una misión específica. El componente principal se le da el nombre de surfactante y su papel es similar al del jabón. La molécula del surfactante tiene también dos extremos, uno polar hidrófilo, soluble en agua, y otro no polar hidrófobo o liposoluble, que disuelve la grasa.
Si los surfactantes tienen una cadena carbonada que no sea lineal las bacterias de los ríos no pueden romperlas y por tanto no pueden degradarlas persistiendo en los ríos la espuma provocada por los detergentes. Actualmente en casi todos los países están prohibidos los detergentes no biodegradables.